Química I. Unidad 2.
Reglas de Nomenclatura.
La nomenclatura química son reglas que se usan para nombrar y representar con signos y fórmulas a los elementos y compuestos químicos.
Existen 3 sistemas de nomenclatura en la que se ordenan y se nombran a los compuestos inorgánicos:
- Sistema de nomenclatura estequimétrico ó sistemático de la Unión Internacional de Química Pura y Aplicada, (IUPAC).
- Sistema de nomenclatura funcional, clásico ó tradicional.
- Sistema de nomenclatura Stock.
Óxidos metálicos.
se obtienen de la combinación del oxígeno con metales y al reaccionar con el agua producen bases.
Nomenclatura de Stock.
Se nombra con la palabra genérica óxido seguido de la preposición de enseguida el nombre del metal con el que se combinó, por ejemplo: óxido de calcio.
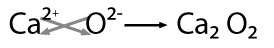
En este ejemplo hay posibilidad de obtener el mínimo común divisor entre los valores por lo que se obtiene: CaO -óxido de calcio-.
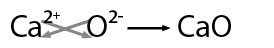
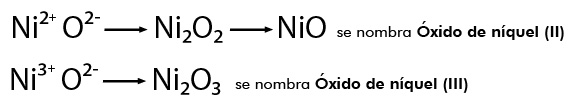
Cuando el metal presenta más de una valencia se nombran con la palabra genérica óxido seguida de la preposición de y después el nombre del metal, escribiendo entre paréntesis con número romano el valor de la valencia, por ejemplo:
Nomenclatura clásica ó tradicional
Estos mismos compuestos se pueden nombrar con la palabra genérica óxido seguida del nombre del metal con el sufijo oso para el valor menor de la valencia y con el sufijo ico cuando el valor de su valencia es mayor, por ejemplo:

Nomenclatura IUPAC
La IUPAC determina que estos compuestos se nombran a partir de la cantidad de elementos que los constituyen, por ejemplo:
NiO se nombra Monóxido de níquel y el Ni2O3 Trióxido de diníquel.
Ejercicios:
Balanceo.
El balanceo iguala el numero de átomos de un elemento en los reactivos y productos.
Unas recomendaciones podrían ser:
- Balancear primero los metales, los no metales y al final el oxígeno y el hidrógeno presentes en la ecuación química.
- Escribir los números requeridos como coeficiente al inicio de cada compuesto.
- Contar el número de átomos multiplicando el coeficiente con los respectivos subíndices de las fórmulas y sumar los átomos que estén de un mismo lado de la ecuación.
Pasos a seguir para realizar un balanceo de ecuaciones químes necesaricas.
- Contar el número de elementos existentes en dicha ecuación de lado de los reactivos y del lado de los productos, empezando por: metales, no metales, dejando para el final al oxígeno e hidrógeno (en caso de que la ecuación los contenga).
- Al hacer el conteo de cada lado, se recomienda indicar con coeficientes la igualación de la cantidad de átomos de los elementos que intervienen en la representación de una reacción química,
- Se coloca el numero de coeficiente de laso de los reactivos para igualar la cantidad de metal en ambos lados de la ecuacion.
- Despues se balancea el no metal, multiplicandolo por un numero que haga que ambos numeros sean iguales.
- Se contabiliza el metal, si se altero equilibrar la cantidad de átomos del elemento en reactivos y en producto.























